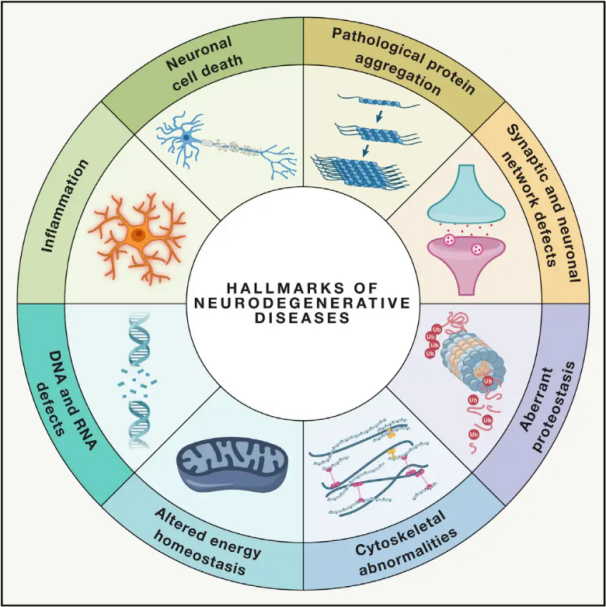
神経変性疾患神経変性疾患(NDD)は、脳または脊髄内の特定の脆弱なニューロン集団の進行性または持続的な喪失を特徴とします。NDDの分類は、神経変性の解剖学的分布(錐体外路疾患、前頭側頭葉変性症、脊髄小脳失調症など)、主要な分子異常(アミロイドβ、プリオン、タウ、α-シヌクレインなど)、主要な臨床的特徴(パーキンソン病、筋萎縮性側索硬化症、認知症など)など、様々な基準に基づいています。これらの分類や症状の現れ方には違いがあるものの、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、アルツハイマー病(AD)などの疾患は、ニューロンの機能不全、ひいては細胞死に至る共通の根本的プロセスを共有しています。
世界中で数百万人が神経変性疾患(NDD)に罹患しており、世界保健機関(WHO)は、2040年までにこれらの疾患が先進国における死因の第2位になると推定しています。特定の疾患に伴う症状を緩和・管理するための様々な治療法は存在しますが、これらの疾患の進行を遅らせたり治癒させたりする効果的な方法は依然として見つかっていません。最近の研究では、治療パラダイムが単なる対症療法から、細胞保護メカニズムを活用してさらなる悪化を防ぐ方向へと移行していることが示唆されています。広範なエビデンスから、酸化ストレスと炎症が神経変性において極めて重要な役割を果たしていることが示唆されており、これらのメカニズムは細胞保護の重要な標的となっています。近年、基礎研究および臨床研究により、高気圧酸素療法(HBOT)が神経変性疾患の治療に有効であることが明らかにされています。
高圧酸素療法(HBOT)について
HBOTは通常、90~120分間、海面気圧である1絶対気圧(ATA)以上に圧力を高めて行います。治療対象となる症状によっては、複数回の施術が必要となる場合もあります。気圧の上昇により細胞への酸素供給が改善され、幹細胞の増殖が促進され、特定の成長因子を介した治癒プロセスが促進されます。
HBOTの応用は、もともとボイル・マリオットの法則に基づいていました。この法則は、圧力依存的に気泡が減少することと、組織内の高酸素レベルの利点を前提としています。HBOTによって生じる高酸素状態が、壊死組織、放射線障害、外傷、火傷、コンパートメント症候群、ガス壊疽など、海中高圧医学会が挙げている様々な病態に効果があることが知られています。特に、HBOTは大腸炎や敗血症など、様々な炎症性疾患や感染症モデルにおける補助治療としての有効性も示しています。抗炎症作用と酸化作用を有するHBOTは、神経変性疾患の治療手段として大きな可能性を秘めています。
神経変性疾患における高圧酸素療法の前臨床研究:3×Tgマウスモデルからの知見
注目すべき研究の一つアルツハイマー病(AD)の3×Tgマウスモデルに焦点を当て、認知障害の改善におけるHBOTの治療可能性を示しました。この研究では、17ヶ月齢の雄3×Tgマウスと、対照群として14ヶ月齢の雄C57BL/6マウスを比較しました。この研究では、HBOTが認知機能を改善するだけでなく、炎症、プラーク量、そしてAD病態に関連する重要なプロセスであるタウリン酸化を有意に減少させることが実証されました。
HBOTの保護効果は、神経炎症の減少に起因すると考えられました。これは、ミクログリア細胞の増殖、アストログリオーシス、および炎症性サイトカインの分泌の減少によって実証されました。これらの知見は、HBOTが認知機能を向上させると同時に、アルツハイマー病に関連する神経炎症プロセスを緩和するという二重の役割を担っていることを強調しています。
別の前臨床モデルでは、1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)マウスを用いて、HBOTの神経機能および運動能力に対する保護メカニズムを評価しました。その結果、HBOTはこれらのマウスの運動活動および握力の向上に寄与し、特にSIRT-1、PGC-1α、およびTFAMの活性化を介してミトコンドリア生合成シグナル伝達の増加と相関していることが示されました。これは、HBOTの神経保護効果におけるミトコンドリア機能の重要な役割を浮き彫りにしています。
神経変性疾患におけるHBOTのメカニズム
HBOTを神経変性疾患(NDD)に利用する基本原理は、酸素供給量の減少と神経変性変化に対する感受性との関係にあります。低酸素誘導因子1(HIF-1)は、低酸素分圧への細胞適応を可能にする転写因子として中心的な役割を果たしており、AD、PD、ハンチントン病、ALSなど様々な神経変性疾患への関与が示唆されており、重要な創薬標的となっています。
年齢は多くの神経変性疾患の重大な危険因子であるため、HBOT が老化神経生物学に与える影響を調査することは重要です。 研究によると、HBOT は健康な高齢者の加齢に伴う認知障害を改善できることが示されています。さらに、重大な記憶障害のある高齢患者は、HBOT を受けた後、認知機能の改善と脳血流の増加を示しました。
1. HBOTによる炎症と酸化ストレスへの影響
HBOTは、重度の脳機能障害患者の神経炎症を軽減する効果が実証されています。炎症性サイトカイン(IL-1β、IL-12、TNFα、IFNγなど)のダウンレギュレーションと、抗炎症性サイトカイン(IL-10など)のアップレギュレーションが認められます。一部の研究者は、HBOTによって生成される活性酸素種(ROS)が、この治療法のいくつかの有益な効果を媒介していると主張しています。したがって、圧力依存性の気泡減少作用と高い組織酸素飽和度の達成に加え、HBOTに関連する良好な結果は、生成されるROSの生理学的役割に部分的に依存していると考えられます。
2. HBOTのアポトーシスと神経保護に対する効果
研究によると、HBOTは海馬におけるp38ミトゲン活性化プロテインキナーゼ(MAPK)のリン酸化を抑制し、認知機能を改善し、海馬損傷を軽減することが示されています。HBOT単独およびイチョウ葉エキスとの併用は、Baxの発現とカスパーゼ9/3の活性を低下させ、その結果、aβ25-35誘導性アポトーシス誘導性齧歯類モデルにおいてアポトーシス率を低下させることが示されています。さらに、別の研究では、HBOTプレコンディショニングが脳虚血に対する耐性を誘導することが示され、そのメカニズムにはSIRT1発現の増加、B細胞リンパ腫2(Bcl-2)レベルの上昇、活性カスパーゼ3の減少が関与していることが示され、HBOTの神経保護作用および抗アポトーシス作用が強調されています。
3. HBOTの循環および神経新生
HBOTを受ける被験者は、血液脳関門の透過性向上、血管新生の促進、浮腫の軽減など、頭蓋血管系に複数の影響を及ぼすことが知られています。HBOTは組織への酸素供給を増加させるだけでなく、血管形成を促進する血管内皮増殖因子などの転写因子を活性化し、神経幹細胞の増殖を刺激することによって。
4. HBOTのエピジェネティック効果
研究により、ヒト微小血管内皮細胞 (HMEC-1) を高圧酸素に曝露すると、上方制御と下方制御の両方の発現を含む 8,101 個の遺伝子が大幅に制御され、抗酸化応答経路に関連する遺伝子発現の増加が強調されることが明らかになりました。
結論
HBOTの使用は長年にわたり大きな進歩を遂げ、臨床現場におけるその有用性、信頼性、そして安全性が証明されてきました。HBOTは神経変性疾患(NDD)の適応外治療として検討され、いくつかの研究が行われてきましたが、これらの疾患の治療におけるHBOTの実践を標準化するための厳密な研究が依然として急務です。最適な治療頻度を決定し、患者への有益な効果の程度を評価するためには、さらなる研究が不可欠です。
要約すると、高圧酸素と神経変性疾患の交差点は、治療の可能性における有望な最前線を示しており、臨床現場での継続的な調査と検証が必要である。
投稿日時: 2025年5月16日

